Нейроны и кальций
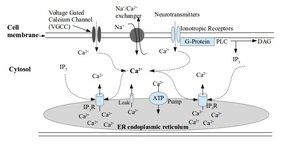
Во всех эукариотических клетках внутриклеточная концентрация Ca2+ (ионизированный кальций) определяет физиологический статус клетки. При стимуляции клеток концентрация Са2+ возрастает от низкого уровня, характерного для состояния покоя, до более высокого уровня, достаточного для активации Са2+-зависимых процессов. Переходные процессы Ca2+ характеризуются различной амплитудой, кинетикой и внутриклеточным расположением и часто организуются в виде колебаний. Благодаря этим свойствам различные сигналы Ca2+ активируют широкий спектр важнейших общих (пролиферация, дифференцировка, апоптоз и транскрипция генов) и специфических для типа клеток процессов. В случае мышечных клеток увеличение Ca2+ включает молекулярные процессы, приводящие к сокращению. В нейронах Са2+ регулирует такие фундаментальные нейрональные процессы, как пластичность и синаптическая передача. В физиологических условиях активация пресинаптических нейронов приводит к высвобождению нейромедиаторов в синаптическую щель посредством Са2+-зависимого процесса. Высвободившиеся нейротрансмиттеры, в свою очередь, активируют рецепторы в мембране последующих нейронов, инициируя тем самым передачу сигнала. В постсинаптических нейронах активация определенных типов рецепторов нейромедиаторов (а именно возбуждающих ионотропных рецепторов и некоторых метаботропных рецепторов) приводит к генерации сигналов Ca2+, запускающих клеточные реакции, специфичные для рассматриваемого типа рецептора. Становится очевидно, что нарушение регуляции гомеостаза Ca2+ ставит под угрозу благополучие нейрона.Гомеостаз Ca2+ в здоровых нейронах
Механизм включения сигналов Ca2+Гомеостаз Ca2+ позволяет контролировать внутриклеточный кальций и генерировать разные сигналы Ca2+, которые различаются по величине в пространстве (от нанодоменов до градиентов во всем теле клетки), временным характеристикам, амплитуде и частоте в случае колебаний, а также по расположению в нейроне. Для последующего считывания сигналов Ca2+ используются локальные и глобальные Ca2+-связывающие сенсорные белки и нижестоящие сигнальные белки, которые передают сообщение клеточным эффекторам. В физиологических условиях электрические или рецептор-опосредованные стимулы генерируют в нейроне различные пространственно-временные сигналы Са2+ в форме временного увеличения цитоплазматической концентрации Са2+. Роль этих сигналов в клетке очень обширна и отражается в количестве и разнообразии Ca2+ каналов в клеточной мембране и в множестве Ca2+-связывающих сигнальных белков. Гомеостаз Ca2+ сочетает в себе механизмы, которые активируют сигналы Ca2+, активируют чувствительные к Са2+ сигнальные каскады и выключают сигналы.
Передача сигналов Ca2+Увеличение внутриклеточного Ca2+, как локальное, так и общее, может происходить в результате притока Са2+ из внеклеточной среды или его высвобождения из внутриклеточных депо Са2+, преимущественно из гладкого эндоплазматического ретикулума (ЭР), основного внутриклеточного кальциевого резервуара для нейронов, в котором концентрации Ca2+ в ~1000 раз выше, чем в цитоплазме. Основными путями поступления Ca2+ в клетку извне являются два типа кальциевых каналов в клеточной мембране: управляемые ионотропными рецепторами (лиганд-зависимые) каналы (receptor-operated channels, ROC) и потенциал-зависимые кальциевые каналы (voltage-operated Ca2+ channels, VOCC), открывающиеся и закрывающиеся в ответ на изменения мембранного потенциала. Приток Ca2+ через ионотропные ROC активируется прямым связыванием специфических агонистов. Проницаемые для кальция ROC включают в себя NMDAR (рецептор, связывающий N-метил-D-аспартат) и AMPAR (рецептор, связывающий аминокислоту AMPA, синтетический аналог глутамата). Эти рецепторы активируются своим физиологическим агонистом глутаматом, основным возбуждающим нейротрансмиттером в центральной нервной системе. NMDAR играют особенно важную роль в ЦНС как эффективные пути поступления Ca2+ в нейроны. Передача сигналов Ca2+ сопровождается активацией других NMDAR-ассоциированных сигнальных молекул, которые запускают специфический клеточный ответ, связанный с этим конкретным путем проникновения Ca2+. Сигнальные комплексы, ассоциированные с NMDAR, варьируются в зависимости от локализации NMDAR, что обеспечивает дополнительные уровни специфичности ответа. Например, приток Ca2+ через внесинаптические NMDAR может инициировать сигнальные каскады, приводящие к апоптозу, тогда как активация NMDAR, расположенных в постсинаптической мембране, может приводить к изменению пластичности нейронов. В зависимости от количества поступающего Са2+ синаптическая передача может подвергаться либо долговременной потенциации, либо долговременной депрессии.
Высвобождение Са2+ из эндоплазматического ретикулума происходит в нейронах через два типа Са2+-каналов/рецепторов: рианодиновые рецепторы (рианодин-чувствительный канал, RyR) и инозитол-1,4,5-трифосфатные рецепторы (рецептор инозитолтрифосфата, IP3Rs). IP3R повсеместно экспрессируются во многих типах клеток, тогда как RyR более характерны для нейронов и мышечных клеток. Высвобождение Са2+ через IP3R требует связывания со вторым мессенджером – инозитолтрифосфатом, генерируемым в ответ на активацию различных рецепторов на клеточной мембране. Повышенная цитоплазматическая концентрация Ca2+ является основным триггером высвобождения Ca2+ через RyR, явление, известное как Ca2+-индуцированное высвобождение Ca2+ (CICR). RyR также регулируется другими внутринейрональными факторами. IP3R, с другой стороны, регулируются множеством факторов как на цитоплазматической, так и на просветной поверхности ЭР, включая связанный с апоптозом цитохром C, связанные с апоптозом белки семейства Bcl-2, некоторые Ca2+-связывающие белки и сам Ca2+. Более высокие концентрации Ca2+ в цитоплазме повышают чувствительность IP3R к IP3, инициируя процесс CICR, тогда как низкие концентрации Ca2+ являются ингибирующими. Явление CICR рецепторов IP3R и RyR имеет решающее значение в формировании сигналов Ca2+, поскольку он связывает и координирует элементарные события, представляющие открытие одного канала или связанной группы каналов в волны и колебания Ca2+. Эти волны распространяют сигнал Са2+ в цитоплазме. Опустошение внутреннего хранилища Са2+ эндоплазматического ретикулума активирует механизм пополнения ЭР, известный как емкостный вход Са2+ (Сapacitative Ca2+ Entry, CCE). CCE – это приток Ca2+ через депо-управляемые каналы (store-operated channels, SOC) в клеточной мембране. В SOC входят каналы семейства Orai, они контролируются путем прямого взаимодействия с белками Stim1 и Stim2, которые являются сенсорами, определяющими дефицит Ca2+ через свой домен, обращенный в просвет эндоплазматического ретикулума.
Механизмы, инактивирующие сигналы Ca2+Сигнал Ca2+ в виде локального или глобального увеличения внутриклеточного Ca2+ воспринимается и передается множеством Ca2+-связывающих белков, большинство из которых относится к семейству EF-hand белков. Передача сигналов Ca2+ к клеточным эффекторам с помощью белков EF-hand опосредована несколькими механизмами. Чаще всего связывание Ca2+ вызывает конформационные изменения в белке EF-hand, что позволяет ему связываться с белками-мишенями. Передача сигнала Са2+ может быть также реализована Са2+-опосредованными изменениями внутриклеточной локализации белков EF-hand. Последующие молекулярные события, передающие сигналы Ca2+, сложны и связаны главным образом с каскадами фосфорилирования. Некоторые из сигнальных каскадов Ca2+, распространяющихся в цитоплазме, могут достигать ядра и влиять на транскрипцию генов.
Нарушение кальциевого гомеостазаМеханизмы клиренса Са2+ в нейронах контролируют продолжительность и распространение сигналов Са2+ и приводят к снижению свободного цитоплазматического Са2+ и восполнения его базального уровня во время восстановления после стимуляции. Быстрое выведение Ca2+ обусловлено Ca2+-связывающими белковыми буферами EF-hand в цитоплазме. Медленный клиренс Ca2+ опосредуется Ca2+-насосами и обменниками. Са2+-АТФазы плазматической мембраны (PMCA) – транспортный белок, служащий кальциевым насосом, удаляющим Ca2+ из всех эукариотических клеток. Также Ca2+ удаляется натрий-кальциевым обменником, транспортирующем ионы кальция из клетки в обмен на ионы натрия, которые поступают в клетку. Внутренние депо Ca2+, такие как ЭР, аппарат Гольджи и митохондрии, обладают собственными механизмами высвобождения и наполнения, которые способствуют формированию сигналов Ca2+ и клиренсу цитоплазматического Ca2+ во время фазы «выключения». Са2+-АТФаза саркоплазматического ретикулума (SERCA) переносит Ca2+ в просвет ЭР, где он может быть в дальнейшем захвачен белками EF-hand. Митохондрии, особенно расположенные вблизи каналов высвобождения Са2+ из ЭР, забирают и впитывают Са2+ преимущественно через унипорт (односторонний транспорт), тогда как высвобождение Са2+ происходит за счет его обмена на ионы Na+ или H+. Когда цитоплазматическое увеличение Ca2+ велико, митохондрии становятся быстро захватывающими Ca2+ буферами, обеспечивая защиту от избытка Ca2+.
Кальций и ААСПостоянные клеточные стрессовые состояния могут преодолеть компенсаторные механизмы и привести к аномально повышенному уровню цитоплазматического Ca2+, что приводит к дисфункции нейронов. Особенно чувствительны к стрессовым условиям мембранные Са2+-гомеостатические компоненты, главным образом насосы и Са2+-каналы. Окислительный стресс, перекисное окисление липидов или мембранное отложение агрегированных белков нарушают работу насосов и Ca2+-каналов в клеточных мембранах, а также в мембранах ЭР и способствуют нейродегенерации, как это наблюдается при болезни Альцгеймера или болезни Паркинсона. Эксайтотоксичность глутамата является еще одним распространенным механизмом, способствующим нейродегенерации при ишемии и многих других патологических состояниях. Это опосредовано чрезмерным высвобождением возбуждающего нейромедиатора глутамата. Чрезмерная активация NMDAR, опосредованная глутаматом, вызывает усиленный приток Ca2+ через этот рецептор. Последствия чрезмерных сигналов Ca2+ варьируются в зависимости от их величины, продолжительности и типа пораженного нейрона. Крайним эффектом нарушения регуляции Ca2+ является гибель клеток, и действительно, было описано несколько каскадов, активируемых Ca2+, вызывающих запрограммированную гибель клеток. Избыточное накопление Са2+ в митохондриях может привести к образованию поры перехода проницаемости и коллапсу трансмембранного потенциала. Это запускает высвобождение цитохрома С и апоптоз. Избыточные сигналы Ca2+ могут также напрямую активировать Ca2+-связывающие кальпаиновые протеазы, что приводит к деградации структурных и ферментативных белков. Однако гибель клеток может начаться не только быстро, но и после длительного периода легких изменений гомеостаза Са2+. Дисрегуляция кальциевого гомеостаза— это нечто большее, чем просто глобальный избыток ионов Са2+ в нейроне, активирующий генерализованные реакции и гибель клеток. Во время физиологического старения или при хронических нейродегенеративных заболеваниях такая дисрегуляция представляет собой сложный пространственно-временной динамический процесс, постепенно поражающий митохондрии нейронов, ЭР, плазматическую мембрану и процессы передачи сигналов.
Глиальные клетки, особенно микроглия и астроциты, являются основными эффекторами иммунных/воспалительных сигналов в мозге. Завышенные уровни глутамата, АТФ, цитокинов и других воспалительных медиаторов во внеклеточной среде могут вызвать завышение Са2+ в глиальных клетках. Астроциты, которые находятся в тесном контакте почти со всеми возбуждающими синапсами в головном мозге, по-видимому, особенно зависят от передачи сигналов Ca2+ и демонстрируют выраженную дисрегуляцию Ca2+ в результате старения и/или заболевания. Завышенные скачки глиального Ca2+ модулируют воспалительный ответ, включая выработку цитокинов. Некоторые медиаторы воспаления, такие как белок S100, сами по себе являются Ca2+-связывающими белками и показывают повышенную активность в присутствии избытка Ca2+. Большинство других цитокинов и медиаторов воспаления косвенно индуцируются Ca2+ посредством активации различных сигнальных каскадов, включающих, среди прочего, CN (кальцинейрин), кальмодулин-зависимые киназы и протеинкиназы С. CN индуцирует экспрессию цитокинов в астроцитах и микроглии посредством активации ядерного фактора активированных Т-клеток (NFAT). Поскольку многие цитокины, индуцированные CN, также стимулируют повышение уровня Ca2+ в глиальных клетках, путь CN/NFAT может поддерживать собственную активацию и распространяться на другие близлежащие глиальные популяции посредством передачи сигналов положительной обратной связи. Таким образом, подобно своей роли положительной обратной связи в нейрональной дисрегуляции Ca2+, CN, по-видимому, является одновременно причиной и следствием активации глии и, как таковой, может быть центральным механизмом хронического нейровоспаления, обнаруженного при старении и возрастных нейродегенеративных заболеваниях. Митохондриальная дисфункция играет важную роль в опосредованном Ca2+ нейрональном апоптозе.
Митохондриальные и цитозольные активные формы кислорода (АФК) и Ca2+ взаимодействуют, дополняют и регулируют друг друга физиологически и патологически. Митохондриальные АФК в условиях гипоксии в астроцитах играют сигнальную роль, запуская передачу сигналов кальция и физиологический ответ на гипоксию. Свободные радикалы могут изменять активность Са2+-каналов, являющихся своеобразными хемосенсорами к АФК (молекулами, способными селективно взаимодействовать с определяемым субстратом, внося соответствующие изменения в системе). Ca2+ стимулирует выработку АФК из разных источников, например, передача сигналов кальция может вызвать активацию НАДФН-оксидаз, экспрессируемых в нейронах и астроцитах — NOX2 и NOX4. Поглощение кальция митохондриями вызывает активацию дегидрогеназ и митохондриального дыхания, а также гиперполяризацию митохондрий. Увеличение мембранного потенциала митохондрий приводит к увеличению вероятности утечки электронов и продукции АФК в митохондриях. Митохондриальная перегрузка кальцием и перепроизводство АФК также действуют взаимодополняюще, вызывая повреждение ДНК и активацию поли(АДФ-рибозо)-полимеразы (PARP) — семейства белков, активация которых ведет к депривации энергии и гибели клеток.
Физиологические дозировки тестостерона вызывают колебания внутриклеточного кальция через изменения в выработке инозитолтрифосфата, требуемого для прохода кальция через IP3R, в клетках нейробластом независимо от андрогенных рецепторов, запуская рост нейритов.
https://pubmed.ncbi.nlm.nih.gov/16449326/
Завышенные дозировки вызывают постоянный высокий уровень Ca2+, изменяя передачу сигналов кальция через IP3R 1 типа, приводя к активации каспаз, апоптозу и клеточной смерти.
https://pubmed.ncbi.nlm.nih.gov/16803879/
ААС увеличивают восприимчивость нейронов к NMDAR гиперстимуляции.
https://pubmed.ncbi.nlm.nih.gov/17662261/
ААС активируют путь CN/NFAT (чрезмерная активация которого индуцирует опосредованную нейровоспалением гибель клеток).
https://www.sciencedirect.com/science/article/abs/pii/S0303720714003050
ААС являются сильными индукторами окислительного стресса и воспаления в различных органах, которые нарушают кальциевый гомеостаз.
https://pubmed.ncbi.nlm.nih.gov/25065671/
ААС нарушают функцию митохондрий, открывая mPTP.
https://pubmed.ncbi.nlm.nih.gov/33984388/
https://pubmed.ncbi.nlm.nih.gov/33677017/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2795716/
Внутриклеточный кальций как терапевтическая мишень
Существуют два основных класса препаратов, нацеленных на защиту нейронов от избытка кальция. Первый – антагонисты NMDAR (например, хорошо описанный в рамках нейропротекции мемантин, блокирующий пору ионного канала), второй – антагонисты VOCC (потенциал-зависимых кальциевых каналов), также называемые блокаторами медленных кальциевых каналов (БМКК), например, нимодипин, селективно блокирующий VOCC L-типа. БМКК широко используются для лечения гипертензии, так как снижают концентрацию ионов кальция в кардиомиоцитах и клетках гладкой мускулатуры сосудов, вызывая вазодилатацию. Нимодипин отличается преимущественным влиянием на сосуды головного мозга благодаря способности проходить через гематоэнцефалический барьер, не вызывая значительной гипотензии. Помимо очевидного трофостимулирующего эффекта, вызванного снятием вазоспазма, он блокирует VOCC L-типа в клетках нервной системы.
Нимодипин может противостоять токсинам, вызывающим дизрегуляцию Ca2+ гомеостаза.
https://pubmed.ncbi.nlm.nih.gov/27481695/
Нимодипин ослабляет токсичность бета-амилоидов благодаря блокировке VOCC.
https://pubmed.ncbi.nlm.nih.gov/8263540/
БМКК рассматриваются как терапевтическая стратегия против болезни Альцгеймера.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3275089/
Нимодипин подавляет токсичные секреции астроцитов и микроглии.
https://pubmed.ncbi.nlm.nih.gov/22659089/
Нимодипин защищает дофаминергические нейроны от воспалительной дегенерации, ингибируя активацию микроглии.
https://pubmed.ncbi.nlm.nih.gov/19049811/
Нимодипин подавляет нейровоспаление, вызванное бета-амилоидами.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3525872/
Наиболее важное терапевтическое свойство нимодипина заключается в том, что он снимает головную боль, возникающую от оргазмов.
https://academic.oup.com/jsm/article-abstract/11/1/311/6958396
Также, что не менее важно, он снимает головную боль, связанную с принятием горячей ванны, распространенную у азиатских женщин среднего возраста.
https://pubmed.ncbi.nlm.nih.gov/30073574
Нимодипин снижает активность коры, требуемую для выполнения когнитивных тестов у здоровых субъектов (это можно рассматривать как повышение эффективности).
https://pubmed.ncbi.nlm.nih.gov/33139710/
Нимодипин может приносить некоторую пользу при различных видах деменции.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7043292/
Несмотря на некоторые ноотропоподобные свойства, нейропротекцию нимодипина стоит рассматривать как дополнение как блокаторам рецепторов ангиотензина (например, к телмисартану, имеющему наилучшее прохождение через ГЭБ) с прицелом на церебральные сосуды, а не как самостоятельное ноотропное средство, подобно тому, как в кардиологической практике принято комбинировать сартаны с БМКК для более эффективной терапии гипертензии, чем монотерапия. Во многих исследованиях на моделях различных церебральных патологий/повреждений блокировка VOCC не показывает таких успешных результатов, как блокировка NMDAR (например, мемантином). Тем не менее, проблема цереброваскулярных патологий при использовании ААС очень актуальна, и нимодипин предлагает свой вклад в ее решение.
Последнее редактирование: