Анаболические стероиды влияют не только на производство эндогенного тестостерона, но и на производство спермы — процесс, который называется сперматогенез. В этой статье я расскажу вам, как работает сперматогенез, как использование анаболических стероидов связано с этим, и что можно с этим сделать.
- Краткий обзор сперматогенеза.
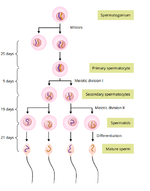
Производство спермы происходит в семенных канатиках и может быть разделено примерно на три стадии, как показано ниже:
Все эти стадии происходят в семенных канатиках. На первой стадии сперматогонии мигрируют среди клеток Сертоли к просвету канатиков. Перемещаясь вдоль клеток Сертоли, сперматогонии медленно делятся и дифференцируются в зрелые сперматозоиды. Сначала они проходят митоз — деление на две идентичные дочерние клетки. Некоторые из этих дочерних клеток пройдут дальнейшие изменения и увеличение, процесс, известный как сперматоцитогенез, который приведет к образованию первичных сперматоцитов. Эти клетки, в свою очередь, пройдут мейоз. Здесь происходят два последовательных деления клеток, в результате чего образуется четыре дочерние клетки. У каждой из этих клеток будет половина числа хромосом родительской клетки. После первого деления клеток мы называем их вторичными сперматоцитами, а после второго мейотического деления они становятся сперматидами. Наконец, сперматиды дифференцируются в сперматозоиды (зрелые сперматозоиды) во время спермиогенеза.
Весь процесс сперматогенеза занимает около 74 дней [1]. После этого потребуется еще от 1 до 21 дня, прежде чем сперматозоиды окажутся в эякуляте [2]. Следовательно, когда сперматогенез останавливается и возобновляется, потребуется время, прежде чем это отразится в анализе спермы.
Сперматогенез сильно зависит от концентрации внутритестикулярного тестостерона (ITT). Учитывая, что ЛГ стимулирует яички к производству тестостерона, и, таким образом, отвечает за концентрацию ITT, ЛГ важен для сперматогенеза. Обычно концентрация ITT примерно в 100 раз выше, чем в кровотоке [3]. Введение 200 мг тестостерона энантата еженедельно значительно снижает эту концентрацию, до примерно 2% от исходного уровня. Хотя это никогда не исследовалось у людей, нижний предел концентрации ITT, необходимой для количественно нормального сперматогенеза у крыс, составляет около 20% от исходного уровня [4]. Как только она падает ниже этого уровня, наблюдается явная связь между снижением концентрации ITT и количеством сперматозоидов.
- Использование анаболических стероидов подавляет сперматогенез.
Анаболические стероиды ингибируют секрецию GnRH гипоталамусом и секрецию гонадотропинов гипофизом. В результате подавляется как производство тестостерона, так и производство спермы. Это может привести к состоянию, называемому азооспермией, при котором в образце семени не обнаруживается сперматозоидов. Или это может привести к олигозооспермии, при которой концентрация сперматозоидов очень низка (меньше 15 миллионов на мл или 39 миллионов на эякулят) [5].
Например, в одном исследовании 65% мужчин стали азооспермичными в течение 6 месяцев после начала приема тестостерона энантата в дозировке 200 мг в неделю [6]. Поскольку ЛГ и ФСГ не были полностью подавлены (-66,7 и -62,5% соответственно), можно предположить, что большее количество мужчин стало бы азооспермичными при более высокой, более подавляющей дозировке. Действительно, когда анаболические стероиды комбинируются с прогестином (что приводит к более сильному подавлению ЛГ и ФСГ), обычно наблюдаются показатели азооспермии почти 90% [7]. Однако в проспективном наблюдательном исследовании (исследование HAARLEM), в котором следили за 100 пользователями анаболических стероидов до, во время и в два момента после их цикла анаболических стероидов, наблюдались аналогичные результаты, как в испытании, в котором 65% мужчин стали азооспермичными [8]. Данные анализа спермы были доступны для 91 пользователя в конце их цикла. Несмотря на практически полное подавление ЛГ и ФСГ у почти всех пользователей, концентрация сперматозоидов была ниже 15 миллионов на мл у 68% пользователей (общее количество сперматозоидов было ниже 40 миллионов у 77%). Здесь может быть ключевым различие во времени подавления, так как в другом исследовании показана кумулятивная степень азооспермии до 6 месяцев, в то время как пользователи анаболических стероидов использовали их на протяжении разного времени, с медианным сроком 13 недель. Кроме того, некоторые пользователи анаболических стероидов использовали хГЧ во время своего цикла, что могло стимулировать сперматогенез до некоторой степени (я вернусь к этому позже). Хотя авторы пишут: "Использование хГЧ не оказало обнаруживаемого эффекта на размер яичек или сперматогенез". Это может быть связано с недостаточной дозировкой хГЧ, неправильным использованием или, возможно, в какой-то степени из-за недостатка статистической мощности. Наконец, высокие дозы ААС — контринтуитивно — могут стимулировать некоторый сперматогенез, заменяя некоторую часть отсутствующей эндогенной андрогенной активности, которая в противном случае имела бы место, как объяснено в предыдущем разделе.
Так или иначе, ясно, что использование анаболических стероидов значительно ухудшает сперматогенез.
- Использование анаболических стероидов уменьшает размеры яичек.
- Терапия гонадотропинами (хГЧ и хМГ/ФСГ) может сохранять сперматогенез.
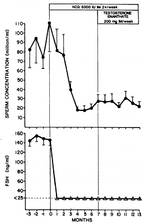
После этого периода 4 участника продолжили прием хГЧ еще на 3 месяца без тестостерона. После этого двум участникам добавили ФСГ (100 МЕ ежедневно), а другим двум - хМГ (75 МЕ ежедневно). Добавление ФСГ или хМГ привело к сильному увеличению производства спермы, достигнув в среднем 103 миллионов/мл в течение последних двух месяцев:
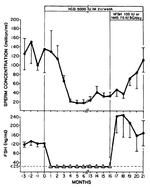
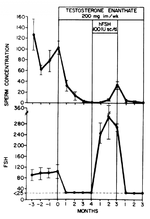
Аналогично, ФСГ самостоятельно может сохранять некоторый уровень сперматогенеза во время подавления терапией тестостероном, как показано на изображении ниже [13]:
Из этих результатов можно сделать вывод, что как ФСГ, так и хГЧ могут сохранять некоторый уровень сперматогенеза во время подавления гонадотропинов тестостероном, но для количественно нормального сперматогенеза необходимы оба гормона. Однако следует отметить, что были значительные межиндивидуальные различия. В предыдущем испытании с хГЧ один мужчина стал азооспермичным во время лечения хГЧ.
Маленькое ретроспективное исследование предполагает, что хГЧ в одиночку, в дозировке 500 МЕ через день, может полностью сохранить сперматогенез в сочетании с терапией замещения тестостерона [14]. Возможно, у этих мужчин была достаточная остаточная секреция ФСГ для полного сохранения сперматогенеза. Кроме того, ретроспективный характер испытания мог привести к смещению результатов.
Это подводит меня к другому аспекту, который я хотел бы обсудить: дозировка. Одно исследование показало, что инъекции хГЧ в дозировке 250 МЕ через день приводят к концентрации внутритестикулярного тестостерона, практически равной исходной [15]. Учитывая ключевую роль внутритестикулярного тестостерона в сперматогенезе, можно утверждать, что такая низкая дозировка должна быть достаточной для сохранения сперматогенеза при использовании ААС. Однако это напрямую не исследовалось в контролируемом испытании.
Более высокая, но все же более низкая дозировка, чем использовалась в испытаниях Мацумото, демонстрирует сохранение некоторого сперматогенеза у пациентов с вторичным гипогонадизмом при дозировке хГЧ от 500 до 2500 МЕ дважды в неделю [16]. Дозы подбирались в зависимости от достигнутых уровней тестостерона. Добавление ФСГ (3x 150 МЕ хМГ в неделю) было необходимо для количественно нормального сперматогенеза. Однако это испытание также было ретроспективным.
Наконец, были высказаны опасения относительно влияния хГЧ на морфологию сперматозоидов. Финское исследование предполагает, что одновременное использование хГЧ и ААС в высоких дозах может негативно сказаться на морфологии сперматозоидов [17]. В исследовании участвовали 18 спортсменов-силовиков, из которых 16 использовали хГЧ в сочетании с высокими дозами ААС. Образцы спермы были взяты в конце цикла ААС, примерно через 1,5 месяца после окончания цикла и примерно через 6 месяцев после окончания цикла. Конечно, производство спермы было нарушено, среднее количество сперматозоидов составило 33 миллиона/мл в конце цикла ААС. Один участник стал азооспермичным (и остался таковым на протяжении последующего периода отмены). Это действительно кажется демонстрацией того, что использование хГЧ может сохранить некоторую степень сперматогенеза при использовании ААС. Однако морфология сперматозоидов составила всего 15% по сравнению с средним показателем 40% в финской когорте доноров спермы. Более того, они обнаружили корреляцию между общей дозой хГЧ и морфологически аномальными сперматозоидами.
Когда они разделили участников на две группы: группу с высокой дозой хГЧ (>12 000 МЕ в общей сложности) и группу с низкой дозой (<12 000 МЕ в общей сложности), они отметили, что была значительная разница в морфологии сперматозоидов между двумя группами. В среднем, 22% были нормальными в группе с высокой дозой и 72% в группе с низкой дозой в конце цикла ААС. Э-э...? Если средний показатель в группе составляет 15%, как он может быть выше в обеих группах? С данными что-то не так. И это одна из проблем этого исследования. (Заметно, что, поскольку группа с высокой дозой имела почти в пять раз выше концентрацию сперматозоидов, абсолютное количество морфологически нормальных сперматозоидов было выше в группе с высокой дозой.)
Можно предположить, что на морфологию могло повлиять отсутствие ФСГ, а не сам хГЧ. Действительно, было обнаружено, что высокие дозы хГЧ улучшают подвижность сперматозоидов и нормальную морфологию у субфертильных мужчин с нормальными уровнями ФСГ [17]. Кроме того, можно предположить, что сам ААС может иметь прямое негативное воздействие на морфологию сперматозоидов при высоких дозах [18]. Это может не проявиться, если производится только небольшое количество спермы, как это было в группе с низкой дозой. Мацумото и др. также показали, что хГЧ (3x 5000 МЕ в неделю) не влияет на морфологию сперматозоидов в сочетании с тестостероном в малом исследовании [19]. Наконец, злоупотребление другими несообщенными веществами также могло повлиять.
- Заключение.
Оригинальная статья на английском языке: https://thinksteroids.com/articles/anabolic-steroids-and-fertility/
Исследования используемые автором:
- Amann, Rupert P. “The cycle of the seminiferous epithelium in humans: a need to revisit?.” Journal of andrology 29.5 (2008): 469-487.
- Rowley, Mavis J., Florence Teshima, and Carl G. Heller. “Duration of transit of spermatozoa through the human male ductular system.” Fertility and sterility 21.5 (1970): 390-396.
- McLachlan, Robert I., et al. “Effects of testosterone plus medroxyprogesterone acetate on semen quality, reproductive hormones, and germ cell populations in normal young men.” The Journal of Clinical Endocrinology & Metabolism 87.2 (2002): 546-556.
- Zirkin, Barry R., et al. “Maintenance of advanced spermatogenic cells in the adult rat testis: quantitative relationship to testosterone concentration within the testis.” Endocrinology 124.6 (1989): 3043-3049.
- T. G. Cooper, E. Noonan, S. Von Eckardstein, J. Auger, H. Baker, H. M. Behre, T. B. Haugen, T. Kruger, C. Wang, M. T. Mbizvo, et al. World health organization reference values for human semen characteristics. Human reproduction update, 16(3):231–245, 2010.
- W. H. O. T. F. on Methods for the Regulation of Male Fertility. Contraceptive efficacy of testosterone-induced azoospermia in normal men. The Lancet, 336(8721):955–959, 1990.
- Page, Stephanie T., John K. Amory, and William J. Bremner. “Advances in male contraception.” Endocrine reviews 29.4 (2008): 465-493.
- Smit, D. L., et al. “Disruption and recovery of testicular function during and after androgen abuse: the HAARLEM study.” Human Reproduction 36.4 (2021): 880-890.
- S. Melmed. Williams textbook of endocrinology. 13th edition. Elsevier Health Sciences, 2016.
- M. Simoni and I. T. Huhtaniemi. Endocrinology of the Testis and Male Reproduction. Springer, 2017.
- Anawalt, Bradley D., et al. “Intramuscular testosterone enanthate plus very low dosage oral levonorgestrel suppresses spermatogenesis without causing weight gain in normal young men: a randomized clinical trial.” Journal of andrology 26.3 (2005): 405-413.
- Matsumoto, Alvin M., Anthony E. Karpas, and William J. Bremner. “Chronic human chorionic gonadotropin administration in normal men: evidence that follicle-stimulating hormone is necessary for the maintenance of quantitatively normal spermatogenesis in man.” The Journal of Clinical Endocrinology & Metabolism 62.6 (1986): 1184-1192.
- Matsumoto, Alvin M., et al. “Reinitiation of sperm production in gonadotropin-suppressed normal men by administration of follicle-stimulating hormone.” The Journal of clinical investigation 72.3 (1983): 1005-1015.
- Hsieh, Tung-Chin, et al. “Concomitant intramuscular human chorionic gonadotropin preserves spermatogenesis in men undergoing testosterone replacement therapy.” The Journal of urology 189.2 (2013): 647-650.
- Coviello, Andrea D., et al. “Low-dose human chorionic gonadotropin maintains intratesticular testosterone in normal men with testosterone-induced gonadotropin suppression.” The Journal of Clinical Endocrinology & Metabolism 90.5 (2005): 2595-2602.
- Depenbusch, Marion, et al. “Maintenance of spermatogenesis in hypogonadotropic hypogonadal men with human chorionic gonadotropin alone.” European journal of endocrinology 147.5 (2002): 617-624.
- Homonnai, Z. T., M. Peled, and G. F. Paz. “Changes in semen quality and fertility in response to endocrine treatment of subfertile men.” Gynecologic and obstetric investigation 9.5 (1978): 244-255.
- Torres-Calleja, J., et al. “Effect of androgenic anabolic steroids on sperm quality and serum hormone levels in adult male bodybuilders.” Life sciences 68.15 (2001): 1769-1774.
- Matsumoto, Alvin M., et al. “Human chorionic gonadotropin and testicular function: stimulation of testosterone, testosterone precursors, and sperm production despite high estradiol levels.” The Journal of Clinical Endocrinology & Metabolism 56.4 (1983): 720-728.